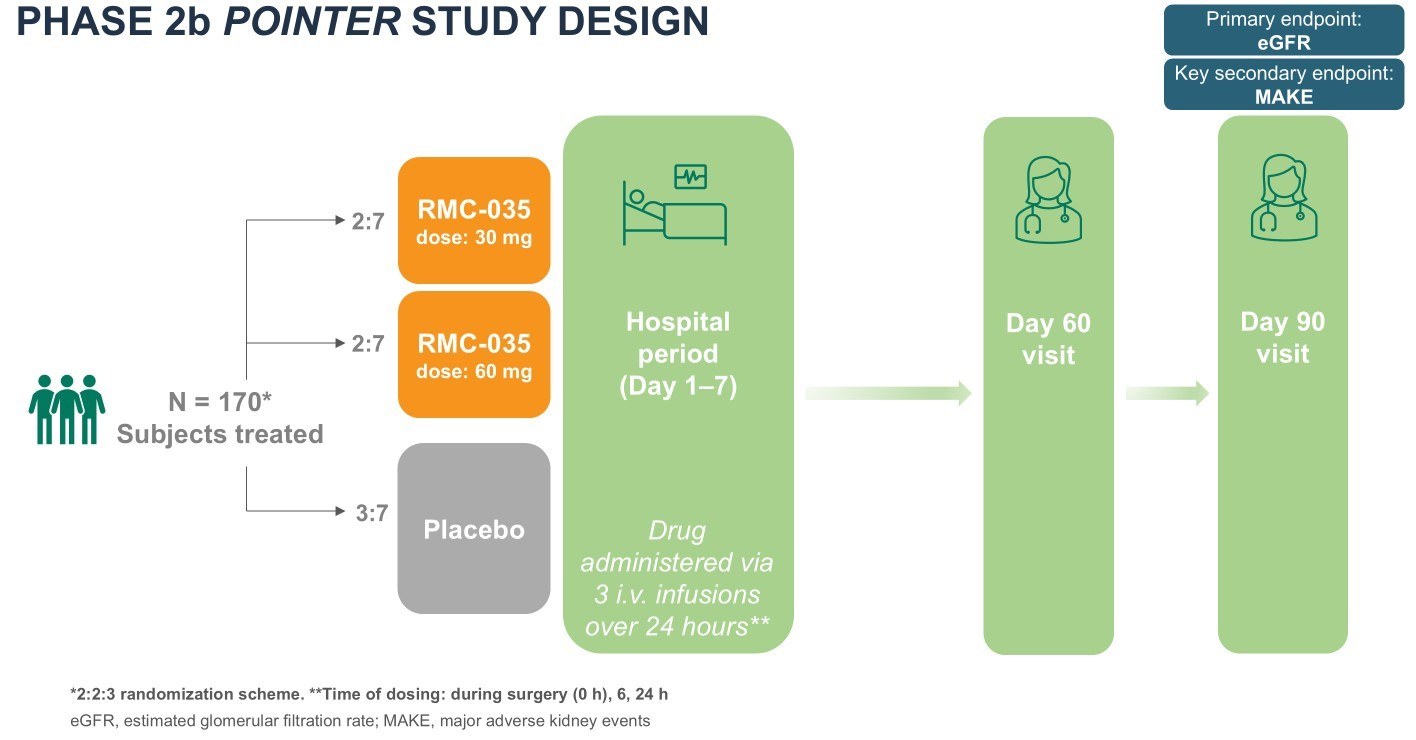
Njurskador vid öppen hjärtkirurgi
Öppen hjärtkirurgi som utförs med hjälp av hjärt-lungmaskin omfattar huvudsakligen så kallad kranskärlsoperation (coronary artery bypass graft, CABG), med eller utan operation av hjärtklaffar eller aortaroten (den första delen av stora kroppspulsådern). Vid denna typ av kirurgi uppstår ofta betydande skador på njurarna.
En viktig orsak till detta är minskat blodflöde och syresättning av njurarna (s.k. ischemi-reperfusionsskada). En annan bidragande orsak till njurskada vid operation är hemolys, vilket innebär att röda blodkroppar skadas och leder till njurskador på grund av skadliga nedbrytningsprodukter från det syrebärande ämnet hemoglobin. Hemolys uppstår när blodet cirkulerar utanför kroppen via hjärt-lungmaskinen samt vid blodtransfusion, som ofta ges i samband med ingreppet.
Till följd av syrebrist och hemolys uppstår dessutom ofta en sekundär inflammation, som bidrar till en fortlöpande skadeprocess i njurarna och ökar risken för ärrbildning och permanent förlust av njurfunktion.